截至目前,全世界痴呆症患者的数量已略超过癌症患者,并有望在未来几十年内进一步增加。然而,痴呆症是包括阿尔兹海默症(Alzheimer’s Disease, AD)在内的多种大脑疾病终末症状的术语,许多研究已将AD的定义与痴呆混为一谈,先前对AD发病机制和药物靶点的不恰当解释可能导致该领域长期以来存在争议。因此,在正确的病理背景下研究AD显得尤为重要。鉴于AD的高遗传力,研究遗传风险似乎是鉴定其分子机制的更可靠方法。但是,中心问题是是否仅存在一条通往揭示AD真相的唯一路线,还是存在多种致病性机制最终共同指向淀粉样斑块和神经纤维缠结的病理改变?
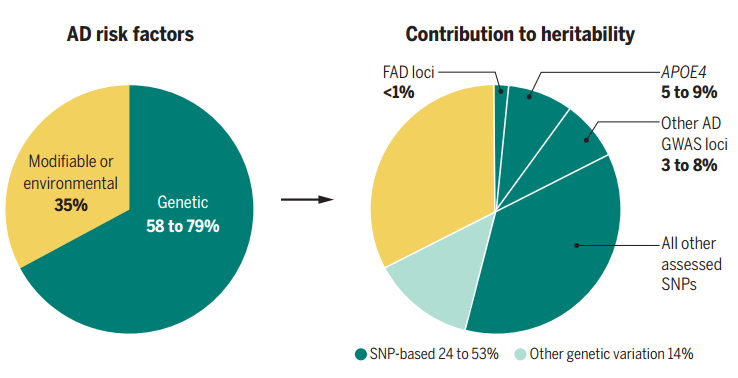
2020年10月2日,来自英国卡迪夫大学的Valentina Escott-Price团队和来自比利时VIB大脑和疾病研究中心的Bart De Stroope团队共同发表了一篇题为“Translating genetic risk of Alzheimer’s disease into mechanistic insight and drug targets” 的综述,作者在这篇文章中通过分析AD遗传风险的不同形式,强调在正确的细胞类型和病理背景下研究基因变异的重要性,并提出缺乏对AD遗传变异机制的理解已成为寻找新药靶标的主要瓶颈。遗传力(heritability),定义为由于遗传因素引起的表型变异的比例,可以用作基于人群的疾病风险度量。目前在AD中研究较为完善的风险遗传变异是编码淀粉样蛋白前体蛋白(amyloid precursor protein, APP)和早老素1和2(PSEN1 / 2)的完全外显突变。它们影响淀粉样蛋白β(amyloid β, Aβ)肽的加工,提示Aβ肽聚集是AD发病进程中的上游事件。然而APP和PSEN1 / 2突变只能解释这些早发性AD(<65岁)病例中的约10%,其余的遗传力可以通过编码SORL1,TREM2, ABCA7等基因中的稀有变体数目的增加,或者一些尚未鉴定的可能为隐性的突变来解释。相比于早发性AD的高遗传力(0.92~1),在65岁后痴呆发作的一大批患者中遗传力仍较高,约在0.58至0.78之间,这在所有迟发性疾病类型当中,是很高的数字。然而这些AD患者的遗传结构远未完全阐明,载脂蛋白ε 4等位基因(APOE4)是目前唯一常见的高风险遗传变异。全基因组关联研究(GWAS)进一步鉴定出许多常见低风险遗传变异。如宽置信区间所示,与许多多基因疾病一样,AD的遗传力估计仍不准确。为了解决AD中的“错失的遗传力”,需要创建更大的GWAS数据集并开发新的数据分析方法(见图1)。将遗传信息转化为发病机制并非易事,例如AD致病突变破坏早老素的稳定性,从而导致长Aβ肽的过早释放这一研究成果就曾花费二十年。此外,关于AD的大多数可用遗传信息仍不准确,致病变异仅占GWAS已鉴定的基因座中的40%。解决这一转化难题的核心在于找出是哪些“中心”基因对疾病进程产生直接影响?不幸的是,超过70%的决定表型的变异都位于“外围”基因中,这类基因仅对核心基因产物的表达或翻译后修饰具有间接影响,对于定义驱动表型的分子机制并不是十分有用。由于存在很多这样的“外围”基因,它们仍占据遗传力的绝大部分。因此,AD中的大部分遗传信息可能仅间接指向疾病的关键生物学途径。其中一组外围基因特别受到关注,这些基因可以编码如转录因子和染色质修饰剂,从而调节几种疾病核心基因的表达或功能。例如,AD风险基因座Spi-1原癌基因(Spi1)编码转录因子Pu.1,后者可以调控许多小胶质细胞基因,参与AD的炎症作用。而这样的主要调节基因通常处于强大的进化约束之下,因此在GWAS中不容易被发现。研究人员可以尝试探索外围基因如何影响核心基因的表达,而先决条件是了解这些外围基因在哪些细胞中发挥作用,因此单细胞分析便显得至关重要。然而,这种反式表达数量性状基因座(transexpression quantitative trait loci, trans-eQTL)映射需要庞大的数据集,并且仅可用于外周血细胞。另一种可能性是关注对遗传力有重大影响的基因变异,APOE4是AD中的唯一示例。APOE的三个主要同工型(ε2,ε3和ε4)由第4外显子内的两个单核苷酸多态性(SNP;rs429358和rs7412)来定义。其中,ε4等位基因使得罹患AD的风险增加了3倍,甚至于在ε4纯合子中增加14倍。相反,ε2等位基因可降低1.7倍的罹患AD的风险。此外,这种风险的易感性与性别和种族背景密切相关,例如女性比男性更易患病, ε4效应在非裔美国人和西班牙裔人口中要小得多,这些数据说明在研究AD的遗传力时多种族遗传研究的重要性.APOE基因座非常复杂,跨度接近2 Mb,并涵盖70多个基因。尽管与ε2和ε4的APOE SNP的连锁不平衡程度较低,在这个巨型基因座中仍有许多其他SNPs与AD显著相关,这可能指向该基因座中的其他AD风险基因,且其中一些SNPs可能会影响APOE的表达。需要注意的是,理解这一点将具有巨大的价值,因为它阐明了该多功能蛋白的上调或下调在什么条件下会影响AD的致病风险。尽管APOE与AD之间存在强相关性,仍不清楚其在脑部炎症中的作用。已知APOE在胆固醇转运和脂质稳态中发挥不可替代的作用,此外,在Aβ的聚集,清除和细胞摄取,以及一些少为人所知的分子途径,例如突触数量和功能,血脑屏障完整性,TAU介导的神经变性中也发挥作用。但是,理清APOE的哪些作用与AD直接相关是很重要的,APOE缺陷在把不同细胞和组织类型中引起的效应不同提示APOE基因只是AD主要的外围调节基因,并非所有受影响的途径均与AD相关。因此,直接针对APOE来预防AD可能会产生多种附加影响,且此类治疗效果也需要格外仔细监测。四、因果:高风险和保护性变体参与APP处理和小胶质细胞功能等位基因系列中基因型-表型剂量反应的证据强有力支持了核心基因功能,在参与Aβ产生的基因观察到这种基因剂量效应,例如APP基因重复可导致AD。其隐性(A673V)和保护性(A673T)等位基因可以影响Aβ聚集的倾向,A673T还降低了APP的β-分泌酶处理。SORL1提供了与AD风险增加的另一个等位基因系列示例。SorlA通过将APP重定向到细胞膜和反高尔基体网络以及将Aβ重定向到神经元的溶酶体来降低Aβ的产生。
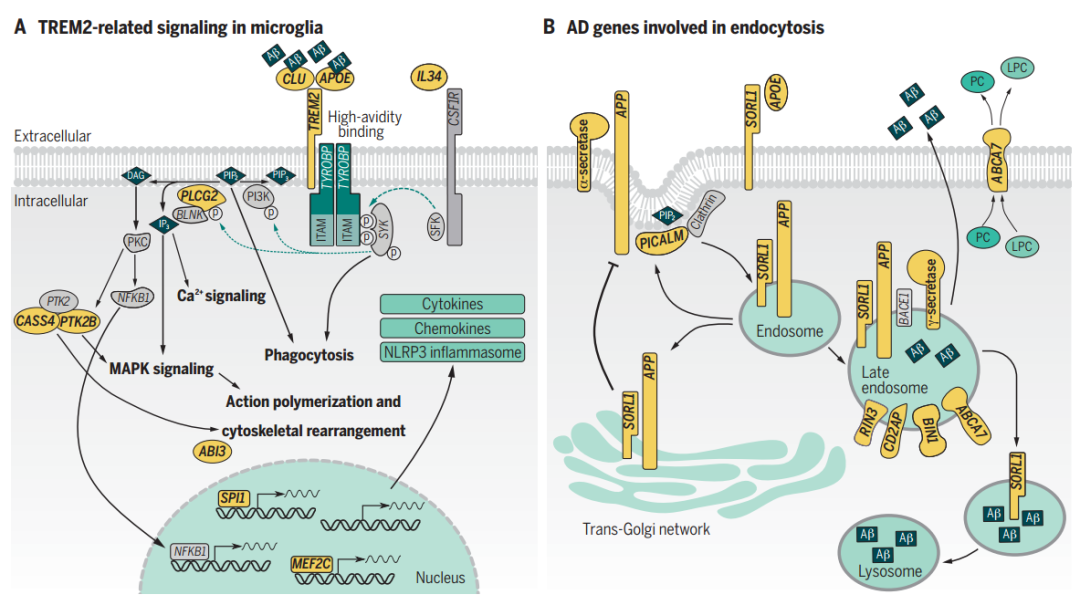
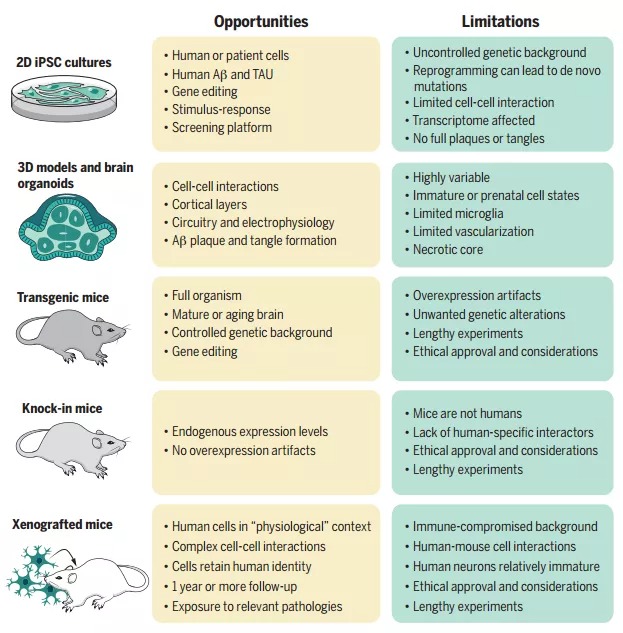
值得注意的是,人类小胶质细胞中SORL1的表达水平相较于小鼠而言高约20倍,从而有力地证明了SORL1缺乏对小胶质细胞功能的影响。常见和罕见的ABCA7变体提供了第三个等位基因系列。ABCA7可以促进磷脂流出细胞,其蛋白截短和错义突变均与AD相关。此外,内含子18中的串联重复序列(范围从300个碱基对到10 kb以上)也与较高的AD风险相关。尚不清楚ABCA7功能丧失如何增加AD的风险,但在小鼠中确实会导致与巨噬细胞和小胶质细胞中Aβ吞噬功能受损有关的Aβ斑块负荷增加(见图2)。除了影响Aβ加工的核心和主要调控基因外,有力的遗传学证据小胶质细胞中表达的基因中存在许多与AD风险相关的常见变体,例如TREM2,PLCG2和ABI3的开放阅读框中的罕见错义突变。值得注意的是,当直接比较一种Aβ模型和一种TAU模型时,可以发现当暴露于Aβ时,许多AD风险基因在小胶质细胞中表达上调,但在TAU中则不那么明显。在上述三种基因中,研究最为深入的为TREM2基因,TREM2是阴离子配体的受体。在AD小鼠模型中,Trem2对于小胶质细胞从稳态转移到活化状态以响应于淀粉样蛋白斑块是必要的。Trem2缺乏导致更多的斑块扩散,小胶质细胞向淀粉样斑块的募集减少,造成更严重的神经损伤。TREM2的稀有Arg47→His(R47H)和更常见的R62H变体会改变其稳定性,并损害TREM2对APOE,ApoJ,低密度脂蛋白和Aβ的亲和力。由于R47H和R62H突变导致TREM2功能部分丧失,并且由于Trem2缺乏似乎加重了小鼠的淀粉样斑块病理,因此大多数药物开发工作都集中在增强TREM2功能上。但是需要认识到增强小胶质细胞活性可能是一把双刃剑,此外需要考虑,在多大程度上可以将小鼠的观察结果推论到人类的病理生理学上?与小鼠模型相比,人类中淀粉样斑块周围的细胞反应要复杂得多。综上所述,AD的遗传学研究为在早发和迟发性疾病中起作用的以Aβ生成,聚集和清除为中心的主要途径提供了有力证据,也强烈暗示小胶质细胞对AD中淀粉样蛋白斑块的反应。假设这些反应是由患者的遗传风险所决定的,则可以预见到一些患者由于其有利的小胶质细胞而免受淀粉样蛋白斑块引起的损伤。该领域的主要问题是小胶质细胞对淀粉样斑块反应哪些方面是有益的而哪些是有害的?遗传风险如何影响这种平衡?考虑到AD中这种细微的细胞内阴阳反应,药物开发必须谨慎行事。AD遗传风险的绝大部分是由基因组中的常见变异所解释,并被GWAS中的SNPs捕获。此类单一变体本身无法预测个人患AD的风险,但可以组合成多基因风险评分(polygenic risk score, PRS)。PRS是定义为个体携带的SNP风险等位基因数量的总和,以其对疾病风险的贡献(效应量)加权的“遗传评分”。目前,大多数研究人员在40个典型GWAS基因组基因座中使用由主要SNP计算的部分AD PRS。但是,更完整的PRS计算包括位点中与AD风险相关但未达到全基因组显着相关性阈值的其他SNP。使用完整的PRS进行AD的预测准确性很高,临床上接受者-操作者曲线下的面积(area under the receiver-operator curve, AUC)为75%,经病理证实的样品为84%。仅使用典型的GWAS基因座会使得分偏向APOE区域的效果,如果按照完整PRS的建议使用AD的所有遗传风险,则相关的小效应大小的SNPs最终将胜过仅有APOE基因座的效应大小。因此,在病理学证实的APOE3纯合子中,完整PRS的预测准确性很高。然而迄今为止,由于缺乏多民族的GWAS数据,PRS方法大部分仅在欧洲人群中进行了评估。针对由遗传证据支持的靶标开发的药物更有可能获得批准。但是,在AD领域,“因果”SNPs在许多情况下是未知的,将遗传学信息转化为药物的最重要限制因素是缺乏良好的AD模型。评估非编码风险变体的功能影响是具有挑战性的,并且由一个特定的SNP是功能性的,还是仅与真正的功能性SNP处于连锁不平衡的问题出发。风险机制只会在与疾病相关的状况中表现出来,因此,在分析SNP的功能后果时,细胞类型和实验环境尤为重要。此外,在基因组的线性DNA序列表示中,SNP经常被分配给最接近的基因,然而,染色质具有复杂的三维结构,增强子或抑制子可对远离其位置的基因表达发挥作用。最近的工作表明,许多因果变异会影响对大脑区域,细胞类型和细胞状态高度特异性的增强子,需要注意的是,与AD相关的变异体主要是髓样和小胶质细胞增强子区域,而不是启动子区域。Nott等人在人诱导多能干细胞(human induced pluripotent stem cells, iPSC)中删除了BIN1增强子,该增强子携带有AD高风险变体rs6733839,然而当作者将这些细胞分化为小胶质细胞,星形胶质细胞和神经元时,BIN1的表达仅在小胶质细胞中受到影响。AD领域确实很难产生能够重现疾病所有特征的良好模型,要模拟人类AD中存在的淀粉样蛋白斑块和缠结,就需要过表达人类TAU,PSEN和APP且都带有家族性AD或额颞变性突变的双甚至三重转基因小鼠,并且这些小鼠将在何种程度上诱导细胞表型以模仿人类的处境,仍是极具挑战性的问题。在对人类多基因疾病进行建模时,不能忽略六千五百万年的进化差异。关于人类特异性细胞生物学,有关人类iPSC的研究已经展开,包括体外3D和类器官培养等,然而每种方法都有其自身的优势和局限性(见图3)。截至目前,在绘制AD的遗传图谱方面已经取得了巨大进展,然而“数量”永远不会取代“质量”,需要更深入的临床表型和生物标记物才能更好地解释基因变异在AD表型特定方面的作用。值得注意的是,在功能层面上,研究人员需要摆脱一种基因,一种功能,一种药物靶点的经典分子生物学范式。基因变异会影响特定遗传背景,特定细胞类型,特定细胞状态以及疾病特定阶段的基因功能。在计算机模拟中和简单的细胞生物学实验中,尽管高通量的方法非常诱人,但也可能非常误导人,并可能危及整个药物开发活动,对诸如AD等复杂的多因素疾病进行药物研发时需要对靶向机制有深入的了解。研究人员可以进一步利用先前完成的遗传学工作来生成更复杂,能更好重现AD发病机制的模型,这将为药物研发打开更多机会,加快从概念到临床的步伐。https://science.sciencemag.org/content/370/6512/61